اطلاعات دارویی و پزشکی
گروههای عمده باکتریها از نظر پزشکی
| باکتریها ارگانیسمهای تکسلولی هستند که اکثرا به صورت آزاد زندگی میکنند و دارای اطلاعات ژنتیکی و تولید انرژی و سیستمهای بیوسنتتیک لازم برای رشد و تولید مثل خود میباشند. باکتریها متنوعترین میکروارگانیسمها هستند که شامل گروههای زیادی میباشند. |
دید کلی
باکتریها مهمترین و متنوعترین میکروارگانیسمها هستند و تعداد کمی در انسان جانوران و سایر موجودات بیماریزا بوده و بطور کلی بدون فعالیت آنها حیات بر روی زمین مختل میگردد. تنها تعداد کمی از باکتریها مانند کلامیدیاها و ریکتزیاها اجبارا انگل داخل سلولی هستند. باکتریها از جنبههایی با یوکاریوتها تفاوت دارند. باکتریها ریبوزومهای 80S ، اندامکهای غشادار مانند هسته ، میتوکندری ،
کروموزوم حلقوی بدون پوشش دارند. باکتریها (به غیر از میکوپلاسماها) دارای دیواره سلولی هستند.
بطور یقین موجودات زنده یوکاریوتیک از موجودات زنده باکتری مانند بوجود آمدهاند و نظر به اینکه باکتریها ساختمان سادهای داشته و میتوان به آسانی بسیاری از آنها را در شرایط آزمایشگاه کشت داد و تحت کنترل درآورد ، میکروب شناسان مطالعه وسیعی درباره فرآیندهای حیاتی آنها انجام دادهاند. در این مبحث باکتریهای شایع با تاکید بر انواع بیماریزا در انسان معرفی میگردد.
اسپیروکتها
این باکتریها در آبهای آلوده ، فاضلابها ، خاک و مواد آلی در حال پوسیدن یافت میشوند. به شکل فنر پیچیده و متحرک هستند. اندازه آنها از چند میکرون تا 500 میکرون است. سه جنس از اسپیروکتها بیماریزا هستند:
- تروپونما: شامل گونه تروپونما پالیزم است که این باکتری عامل مولد بیماری سیفلیس میباشد.
- بورلیا: این باکتری عال مولد بیماری تب راجعه میباشد.
- لپتوسپیرا: این باکتری از راه شکافها و زخمهای پوست وارد میشود و شایعترین شکل بیماری ، عفونت کلیه است.
کوکوسها و باسیلهای گرم منفی هوازی
جالبترین باکتریها در این گروه انواع متعلق به جنس سودوموناس است یکی از گونههای سودوموناس ، سودوموناس آئروجینوزا میباشد که این باکتری عفونتهای مجاری ادراری ، عفونتهای زخمی و سوختگیها ، آبسه و مننژیت را ایجاد میکند. باکتریهای این گروه قادر به ساختنآنزیمهای متعددی هستند و بدین نحو در تجزیه مواد شیمیایی نظیر حشره کشهایی که به خاک افزوده میشوند، کمک میکنند. مقاومت این گروه به آنتی بیوتیکها از نظر پزشکی حائز اهمیت است.
باسیلهای گرم منفی بیهوازی اختیاری
آنتروباکتریاسه
این خانواده شامل گروهی از باکتریهای ساکن روده انسان و سایر جانوران است. جنسهای باکتریهای روده عباتند از: اشیرشیا ، شیگلا ، کلبسیلا ، آنتروباکتر و ... . اشیرشیاکلی یکی از ساکنین اصلی روده بوده و آشناترین میکروبی که پژوهشهای فراوانی بر روی آن صورت گرفته است. سالمونلا یکی از باکتریهای بیماریزا است که یکی از گونههای آن مولد
بیماری تب تیفوئید میباشد. گونههای شیگلا عامل اسهال خونی است. کلبسیلا عامل عفونت مجاری تنفسی ذاتالریه است. سرشیا عامل عفونت ادراری و تنفسی است و آنتروباکتر در عفونتهای مجاری ادراری نقش برعهده دارند.
ویبریوناسه
جنسهای مهم این خانواده شامل ویبریو و آئروموناس میباشد. گونه بیماریزا ویبریوکلرا است که عامل بیماری وبا میباشد. باکتریهای متعلق به آئروموناس عامل
بیماری ذاتالریه و اختلالات روده میباشند.
هموفیلوس
یکی از گونههای آن به نام هموفیلوس آنفلوآنزا عامل مننژیت در کودکان و جوانان میباشد.
باکتریهای گرم منفی بیهوازی
در این گروه دو جنس مهم از نظر پزشکی به نامهای نایسریا و موراگزلا وجود دارد. نایسریا از اهمیت ویژهای برخوردار است و انگل غشاهای مخاطی در انسان بوده و درجه حرارت نزدیک درجه حرارت بدن انسان زندگی میکند، گونههای بیماریزا شامل باکتری مولد
بیماری سوزاک و باکتری مولد مننژیت میباشد. باکتریهای جنس موراگزلا در التهاب بافت ملتحمه چشم دخالت دارند.
کوکوسهای گرم منفی بیهوازی
این باکتریها اختصاصا به صورت دوتایی ، گاهی تکتک ، خوشهای یا زنجیری قرار میگیرند. و همگی بدون حرکت و بدون اسپور هستند. باکتریهای متعلق به جنس ویلونلا بخش از میکروفلور طبیعی دهان و پلاک دندانی هستند.
کوکوسهای گرم مثبت
این گروه از باکتریها از نظر پزشکی شامل دو جنس استافیلوکوکوس و استروپتوکوکوس هستند. عدهای از باکتریهای استافیلوکوکوس مواد سمی تولید میکنند که گویچههای قرمز خون و
گویچههای سفید خون را نابود میکنند. چندین نوع عفونت استافیلوکوکی بوسیله گونه استافیلوکوکوس اورائوس ایجاد میشود که در ایجاد
عفونتهای پوستی ، ذاتالریه و آبسههای مغزی دخالت دارند. استرپتوکوکها در تب زایمان ، تب مخملک ، گلودرد ، تب روماتیسمی و پوسیدگی دندان دخالت دارند.
باسیلها و کوکوسهای اسپوردار
دو جنس مهم اسپوردار باسیلوس و کلسترویدیوم میباشند. باسیلوس آنتراسیس عامل
بیماری سیاه زخم که معمولا در گاو ، گوسفند و اسب بیماری تولید میکند، میتواند به انسان انتقال پیدا کند. باکتریهای متعلق به جنس کلستریدیوم بیهوازی اجباری هستند و بیماریهایی که تولید میکنند شامل کزاز و
بوتولیسم میباشد.
باکتریهای میلهای شکل گرم مثبت بدون اسپور
مهمترین این گروه جنس لاکتو باسیلوس میباشد. لاکتوباسیلوسها در روده و حفره دهانی زندگی میکنند. در دهان این باکتریها نقشی در پوسیدگی دندان به عهده دارند. در صنعت از این باکتریها برای تولید کلم شور ، دوغ و ماست استفاده میشود. باکتری بیماریزای متعلق به این گروه "یستریا منوسایتوجنز" است که در تولید آبسه ، انسفالیت و آندوکاردیت ، دخالت دارد.
اکتینومیستها
از جنسهای مهم این گروه میتوان کورینه باکتریوم ، مایکوباکتریوم ، نوکاردیا ، اکتینومیسس و استرپتومایسس را نام برد.
- معروفترین و شناخته شده ترین گونه کورینه باکتریوم ، کورینه باکتریوم دیفتریا میباشد که عامل بیماری دیفتری میباشد.
- دو گونه مهم مایکوباکتریوم توبرکلوزیسکه عامل سل و مایکوباکتریوم لپرا که عامل جذام میباشد.
- گونههای متعلق به نوکاردیا در عفونتهای ریوی و عفونت مخرب دست و پا دخالت دارند.
ریکتیساها
این گروه شامل ریکتسیا و کلامیدیا میباشند. این دسته از باکتریها ، انگلهای درون سلولی اجباری هستند که فقط در درون سلول میزبان قادر به تولید مثل هستند و از این لحاظ به ویروسها شباهت دارند. یکی از بیماریهایی که عامل مولد آن ریکتسیا میباشد،
تیفوس است که بوسیه
شپش منتقل میشود ، گونههایی از کلامیدیاها موجب کوری در انسان میشوند.
مایکوپلاسما
مایکوپلاسما باکتریهای فاقد
دیواره سلولی هستند. مهمترین گونه بیماریزا در انسان مایکوپلاسما نومونیا است که عامل ذاتالریه ابتدایی آتیپیک میباشد. این بیماری در بخش فوقانی
دستگاه تنفس و ندرتا مانند سایر ذاتالریهها ، عارض میشود.
چهارشنبه 21/8/1393 - 16:41
اطلاعات دارویی و پزشکی
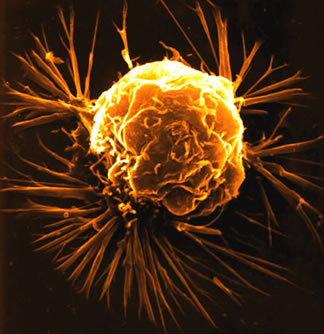
دید کلی
آیا در حال حاضر ترکیبی شیمیایی که بتواند نوعی سرطان را درمان کند، شناخته شده است؟ آیا داروهای ضد سرطان Antineoplastic Agents ، طول عمر بیمار را اضافه میکند؟
سرطان معالجه ای محدود
کوشش فوقالعاده زیادی در مورد مطالعه و آزمایشهای ترکیبات علیه انواع سرطان انجام گرفته است، ولی قبل از اینکه موانع بطور حقیقی برطرف گردد، تستهای تشخیص مطمئن برای شناسایی سریع سرطان در انسان باید توسعه داده شود و در سطح اساسیتری ، تجسس باید از منشاء ایجاد سرطان خود به خود انجام گیرد.
در حال حاضر هیچ
ترکیب شیمیایی که بتواند نوعی سرطان را درمان کند، شناخته نشده است هنوز معالجه سرطان ، اکثرا محدود به جراحی و بکار بردن
اشعههای یونیزه کننده میباشد. با این وصف ، داروهای ضد سرطان زیادی وجود دارد که قادر به تخفیف درد ، اضافه کردن طول مدت عمر به میزان قابل توجه ، جلوگیری از متاستاز بعد از عمل جراحی و حداقل از بین بردن موقت تومور میباشد.
همچنین این داروها قادر به برگشت دادن موقت بعضی انواع سرطان است که با جراحی یا اشعه ، درمانپذیر نیست، دوز موثر ، اکثرا نزدیک به دوز سمی آنهاست و تمام این داروها نسبتا دارای شاخص درمانی کم میباشد.
اثر درمانی
برای اینکه بتوان ماکزیمم اثر درمانی را بدست آورد، دارو مکررا تا حد دوز سمی تجویز میشود، با این امید که سلولهای سرطانی بتواند خیلی کندتر از سلولهای طبیعی رشد کرده ، بحال اول برگردد. هر دوره معالجه احتمالا اثرش از دوره معالجه قبل کمتر است.

ترکیبات شیمیایی برای شیمی درمانی سرطان
برخی از ترکیبات شیمیایی بکار رفته در شیمی درمانی سرطان عبارتند از:
- عوامل آلکیله کننده ، نیتروژن مستارد و ترکیبات وابسته آن :
نیتروژن مستارد ، عاملی موثر بر ضد سرطان است و اثر ضد سرطانی ترکیبات نیتروژن مستارد را بعلت حلقوی شدن آن در آب و تشکیل یونهای خیلی فعال اتیلین اسیونسیوم میدانند، که با ترکیباتی که دارای هیدروژن قابل تعویض هستند.
- آنتیمابولیتها ، آنالوگهای اسید فولیک و پورین|آنالوگهای پورین و پیریمیدین
- هورمونها ، ACTH و کورتیزون و همجنسهای آن ، استروژنها و آنرژنهای متعدد
- گروه متفرقه که شامل اورتان و آلکالوئیدها میباشد :
اورتان کریستالهایی است بسیار محلول در آب و با اسیدها و قلیاها ناسازگار میباشد. اثر سمی آن روی سلولها در بسیاری موارد شبیه اثر نیتروژن مستارد است، ولی اورتان داروی بسیار ضعیفتری است.
آینده ؟!
آیا در آیندهای نه چندان دور بشر خواهد توانست داروهایی برای انواع سرطانها ارائه دهد و از این بلای مهلک جان سالم بدر برد؟
چهارشنبه 21/8/1393 - 16:41
بیماری ها
| سرطان مری عبارت است از هجوم سلولهای سرطانی به ناحیه مری که باعث تنگ شدن محل عبور غذا از مری به معده میشود. این امر باعث اشکال در بلع غذا و اختلال حرکتی عضله صاف مری و در نهایت باعث اختلال در هضم غذا میشود. |
دیدکلی
در
ایالات متحده آمریکا 80 تا 90 درصد موارد سرطان قابل انتساب به مصرف زیاد الکل و سابقه طولانی مدت استعمال
سیگار است. وقوع سرطان مری را به خوردن سایر مواد کارسینوژن مثل
نیتریتها ، مخدرهای دود شده ،
سموم قارچی در سبزیجات ترش شده و نیز آسیب مخاطی ناشی از حبوبات فیزیکی طویل المدت نظیر
چای داغ ، تنگیهای ناشی از تشعشع و آشالازی (اختلال حرکتی عضله مری) هم نسبت دادهاند.
علایم بالینی
علایم کلی در قسمت عمده بیماران دیسفاژی پیشرونده (اشکال در بلع) به صورت کاهش وزن در مدت کوتاه میباشد. دیسفاژی ابتدا مربوط به
مواد غذایی جامد است و به تدریج پیشرفت نموده مشمول غذاهای نیمه جامد و حتی مایع نیز میگردد. احساس توده و برجستگی در گلو و بلع دردناک ، درد انتشار یابنده به سینه یا پشت ، رگورژیتاسیون (بالا آمدن غذای هضم شده بدون زور و فشار) غذای هضم نشده همراه با تنفس بدبو و به دنبال آن سکسکه که ممکن است با استفراغ و پنومونی آسپیراتیو (التهاب لایههای ریه) همراه باشد، از دیگر علائم این بیماری است.
تشخیص
تشخیص در 95 درصد موارد بوسیله ازوفاگوستروئودنوسکوپی همراه با بیوپسی (نمونه برداری از بافت زنده) داده میشود.
سایر روشهای تشخیصی شامل
برونکوسکوپی ، مدیاستینوسکوپی ، اسکن توموگرافی کامپیوتری قفسه صدری و شکم میباشد که در صورت وسعت گسترش تومور به مدیاستن و
عقدههای لنفاوی پاراآئوتیک انجام میشود.
درمان
پیش آگاهی بیماران مبتلا به کارسینوم مری وخیم است. به همین جهت بسیاری از پزشکان معالجه خود را منحصر به کنترل بیماری مینمایند. جراحی تمام تومور (ازوفاکتومی) تنها در 40 درصد موارد مسیر بوده و سلولهای تومورال باقیمانده کرارا در حاشیه ناحیه بریده شده ، وجود دارند. نتایج شیمی درمانی با مخلوطی از داروها مشتمل بر
سیس پلاتین در 30 تا 60 درصد بیماران درمان شده ، موفقیت آمیز میباشد. اقدامات درمانی مشتمل بر شیمی چند دارویی ،
رادیوتراپی به عنوان راه درمانی اولیه است که به تنهایی یا به دنبال اقدام به رزکسیون جراحی نیز صورت میپذیرد.
برای بیماران لاعلاج که تومورهای مری با جراحی قابل رزکسیون نیست، معالجه دیسفاژی ،
سو تغذیه و فیستول به مری عملکرد عمدهای محسوب میشود. روش تسکین این عوارض وابسته به سرطان دیلاتاسیون مکرر توسط
آندوسکوپ ، انجام جراحی به منظور گاستروستومی یا ژوژنوستومی به منظور رساندن مایعات و غذا به مریض و وارد کردن یک پروتز پلی ونیل برای از میان بردن مواد غذایی از کنار تومور میباشد. به نظر میرسد سوزاندن آندوسکوپ تومورهای مسدود کننده توسط لیزر امید بخش ترین این روشها است.
چهارشنبه 21/8/1393 - 16:40
بیماری ها
| سرطان یعنی رشد ، تکثیر و گاهی انتشار غیر طبیعی سلولهای بدن. تمامی سرطانها دارای الگوی رشد مهارگسیخته و تمایل به جدا شدن از منشا اصلی و متاستاز هستند. |
دید کلی
جسم انسان از میلیونها میلیون سلول تشکیل شده است که در کنار هم ، بافتهایی مانند ماهیچهها ، استخوان و
پوست را میسازند. اغلب سلولهای طبیعی بدن در پاسخ به تحریکاتی که از داخل و خارج بدن به آنها وارد میشود، رشد و تولیدمثل میکنند و در نهایت میمیرند. اگر این فرآیند در مسیر تعادل و صحیح خود اتفاق بیفتد ، بدن سالم میماند و عملکرد طبیعی خود را حفظ میکند. اما مشکلات ، زمانی شروع میشود که یک سلول طبیعی دچار " جهش " و یا تغییر شده و به سلول سرطانی تبدیل میشود.
نحوه پیدایش سرطان
یک سلول طبیعی ممکن است بدون هیچ دلیل واضحی به یک سلول سرطانی تبدیل شود، ولی در اغلب موارد ، تبدیل در اثر مواجهه مکرر با مواد سرطانزا مانند الکل و دخانیات صورت میگیرد. شکل ظاهری و نیز عملکرد سلولهای سرطانی شده با سلولهای طبیعی تفاوت دارد. جهش یا تغییر ایجاد شده در DNA یا ماده ژنتیکی سلول اتفاق میافتد. DNA همان مسئول کنترل شکل ظاهری و عملکرد سلول است. وقتی DNA یک سلول تغییر میکند، آن سلول با سلولهای سالم کنار خود تفاوت مییابد و دیگر کار سلولهای طبیعی بدن را انجام نمیدهد. این سلول تغییر یافته از سلولهای همسایهاش جدا میشود و نمیداند چه زمانی رشدش باید به پایان برسد و بمیرد. به عبارت دیگر سلول تغییر یافته از دستورها و علائم داخلی که سلولهای دیگر در کنترل آنها هستند، پیروی نمیکند و به جای هماهنگی با سلولهای دیگر خودسرانه عمل میکند.
بدخیم شدن سرطان
وقتی سلول " جهش یافته " تقسیم میشود ، به 2 سلول جدید " جهش یافته " تبدیل میگردد و این فرآیند به همین ترتیب ادامه مییابد تا همان یک سلول موذی به تودهای از سلولها که تومور نامیده میشود، تبدیل میگردد. گاهی این تومورها ،
خوش خیم بوده و رشد نمیکنند. ولی در صورتی که سلولهای تومور رشد کنند و تقسیم شوند و سلولهای طبیعی اطراف خود را از بین ببرند و به نقاط دیگر بدن هم دستاندازی کنند، تومور
بدخیم محسوب میشود. بزرگترین خطر تومورهای بدخیم ، توانایی آنها در حمله به بافتهای سالم و پخش شدن در بدن است و این همان متاستاز سرطان است. هر چه تومورها رشد کنند و بزرگتر شوند، جلوی رسیدن مواد غذایی و اکسیژن را به سلولهای سالم میگیرند و با پیشرفت سرطان ، سلولهای سالم میمیرند و عملکرد و سلامت بیمار از بین میرود. اگر جلوی این فرآیند گرفته نشود، سرطان به مرگ میانجامد.
علائم هشدار دهنده سرطان
- خونریزی غیر طبیعی در هر نقطه از بدن.
- پیدایش هرگونه توده سفت سلولی در زیر پوست، مثلا در سینه یا نقاط دیگر.
- پیدایش زخمی که به آسانی بهبود نمییابد (بویزه در اطراف زبان ، دهان و لبها).
- سوء هاضمه دائمی
- تغییراتی در وضع خالها یا زگیل از قبیل تغییر رنگ ، بزرگ شدن ، خارش ، دردناک شدن و یا خونریزی از آنها که به مدت طولانی ادامه یابد.
- پیدایش آشفتگی در اعمال رودهها یا مثانه که با درمانهای عادی بهبودی نیابد.
- سرفه ، گرفتگی صدا و یا مشکل شدذن عمل بلع به مدت طولانی.
اگر هر یک از این علائم فوق بیش از دو هفته ادامه یابد، باید بیمار تحت بررسی تخصصی قرار گیرد. البته در بشتر موارد این علائم حاکی از وجود سرطان نیستند.
انواع سرطانها
اغلب سرطانها به سه دسته عمده تقسیم میشوند:
- کارسینوم : شامل سرطانهایی میشود که از سلولهایی که سازنده پوست هستند (مثل سرطان پوست) و یا لایه داخلی اعضا را میپوشانند (مثل سرطان ریه) و یا سازنده غدد هستند (مثل سرطان سینه) منشا میگیرد.
- سارکوم : این دسته سرطانهایی هستند که از بافت همبند مثل غضروف ، استخوان و ماهیچه منشاء میگیرند. از اینرو سرطان استخوان یا سرطان ماهیچه را در هر نقطه از بدن سارکوم میگویند.
- لوسمی و لنفومها : شامل سرطانهایی است که از سلولهای تشکیل دهنده خون و سلولهای ایمنی منشاء میگیرند.
در کشورهای غربی ، سرطان پوست شایعترین سرطان است و پس از آن سرطان سینه ،
ریه ، پروستات ،
روده بزرگ ، مثانه و رحم قرار دارد.
راههای پیشگیری
پیشگیری اولیه از سرطان با اجتناب از عامل مسبب یا مصرف مادهای که مانع از پیدایش فرایند بدخیمی میشود ، صورت میگیرد و
شامل اقداماتی برای کاهش خطرات شیوه زندگی (اجتناب از توتون ، مصرف غذاهای کم چرب و غنی از فیبر ، استفاده از کرم ضد آفتاب) و مصرف عوامل پیشگیری شیمیایی است. عوامل پیشگیری شیمیایی داروها یا ریز مغذیها (مواد معدنی یا ویتامینها) هستند. عوامل زیر نیز در پیشگیری از سرطانها موثرند.
- عدم استفاده از مشروبات الکلی و دخانیات.
- صرف غذاهایی که به صورت آبپز تهیه میشود.
- عدم استفاده از غذاهایی که آثار سوختگی در آنها نمایان است.
- استفاده از سبزیجات و انواع میوهها
- استفاده کمتر از گوشت قرمز
- رعایت کامل امور بهداشتی
درمان
امروزه اکثر سرطانها درمان قطعی ندارند اما برای جلوگیری از رشد و پیشرفت آنها از روشهای جراحی ،
پرتو درمانی ، شیمی درمانی ،
هورمون درمانی ،
پیوند مغز استخوان و ... استفاده میشود. البته یافتههای جدید زیست شناسی سلولی تومور در روشهای درمانی ترکیبی طی یک برنامه هماهنگ مورد بهره برداری قرار میگیرند.
چهارشنبه 21/8/1393 - 16:39
اطلاعات دارویی و پزشکی
| تابش پرتوها بر موجودات زنده دارای دو اثر است، آثار تصادفی و غیر تصادفی. آثار تصادفی آثاری هستند که برای آنها دوز (مقدار) آستانه معلومی وجود ندارد. یکی از این آثار تصادفی ، سرطانزایی پرتوها در بافتها و اندامهای مختلف است. |
اطلاعات اولیه
گروهی از واکنشها یا پاسخها که تحت تاثیر برخورد پرتوها به بافتها یا اندامها ، ایجاد میشود، تغییرات ژنتیکی و
تومورزا هستند که برای آنها مفهوم آستانه ، کمتر کاربرد دارد. برای این پاسخهای اخیر به تابش یوننده ، جامعه علمی به این نظر رسیده است که تغییرات در هر سطح پرتوگیری ، میتواند ایجاد شود، هرچند که به ازای دوزهای پایین ، فراوانی تغییرات در جمعیت پرتو گرفته ممکن است پایین فرض شود، ولی فراوانی رخداد ، باز هم صفر نیست. پاسخهای بدون آستانه مانند سرطانزایی احتمالا فقط به تغییر یک یا حداکثر چند یاخته بستگی دارند تا پاسخ مربوطه را تامین کنند.
آثار تصادفی عبارتند از آثاری که برای آنها ، آستانهای برای پاسخ وجود ندارد و برای آنها شدت پاسخ به شدت تابش ، بستگی دارد، یعنی که
همه یا هیچ. یکی از این اثرات تصادفی ، تولید سرطان است. آثار تصادفی ، فرایندی را توصیف میکند که شامل عنصری شانسی در نتیجه است و یا به بیان دیگر ، پیش بینی درباره این فرایند بر پایه تصادف و یا احتمالات صورت میگیرد. در میان هر جمعیت وسیعی از یاختهها ، یک عبارت احتمالی برای این احتمال وجود دارد که یک تک یاخته به یک تیره بالقوه کلنی ، برای بعضی نشانههای اختصاصی جدید ، تبدیل شود و این نشانه اختصاصی ممکن است به هر یک از یاختههای اولاد ، به صورت یک خصیصه توارثی برای همیشه منتقل شود. (ژنتیک و سرطان)
تاریخچه
سالهای چندی از کشف
اشعه x از سوی
رونتگن گذشت تا پی بردند تابش یوننده به ایجاد سرطان در انسانهایی میانجامد که تحت تاثیر تابش این پرتوها قرار میگیرند. التهاب پوست دستها ، اما بدون بروز سرطان اثبات شده در سال 1896 گزارش شد. اولین تغییرات سرطانی مشخص در سال 1902 در یک زخم ناشی از پرتو x گزارش شد و
سرطانهای خون مشخص ناشی از تابش پرتوها ، در سال 1911 گزارش شده است. تصور میشد که این سرطانهای اولیه پیامد
پرتوگیری بیش از حد تابش یوننده باشد، اما چندین سال بعد بود که توانستند به کمک مطالعات گسترده نشان دهند که سرطان میتواند با مقدار کم تابش پرتو ، ارتباط داشته باشد.
سرطانزایی تابش در حیوانات آزمایشگاهی
تولید سرطان در حیوانات آزمایشگاهی ، خیلی پیش از نمایش صریح ارتباط میان پرتوگیری تابش یوننده در دوزهای کم ، مانند آنچه پرتوشناسان دریافت میکنند و نیز سرطان در نزد انسان ، شناخته شده بود. در سالهای 1930 ، آزمایشگران افزایش انواع سرطانهای خون در موش را به نمایش گذاشتند. در سال 1958
آپتون و دیگران ، اطلاعات گستردهای را درباره روابط دوز _ پاسخ ، برای بروز
سرطان مغز استخوان و
سرطان لنفاوی در موش انتشار دادند که برخی از آنها به قرار زیر است:
- احتمال بروز تومور در حیواناتی که هرگز ، پرتو نگرفتهاند، مخالف صفر است.
- منحنی احتمال بروز سرطان برحسب دوز ، به ازای دوزهای کم به شدت افزایش مییابد.
- یک مقدار بیشینه برای بروز دست یافتنی (سرطان) وجود دارد.
- معمولا احتمال بروز به ازای دوزهای بالاتر از بیشینه ، کاهش مییابد، ولی این کاهش با انجام تصحیحهای مربوط به مرگ ناشی از سایر عوامل از بین میرود.
چرا بیشینهای برای بروز تومور در حیوانات پرتو دیده ، وجود دارد؟ مطالعات مربوط به تغییر شکل یاخته این موضوع را مطرح و تائید کردهاند که با افزایش دوز تابش ، از بین رفتن یاختههای بالقوه تغییر شکل یافته به مسالهای مهم تبدیل میشود. در نتیجه تعداد یاختههایی که زنده میمانند تا سرانجام توموری را بوجود آورند، در دوزهای بسیار زیاد کاهش مییابد. این توضیح برای توجیه وضع ثابت پیوسته منحنی دوز _ پاسخ مشاهده شده برای بسیاری از تومورها ، قانع کننده نیست. توصیف کمی خطر مرتبط با پرتوگیری تابش یوننده برای جمعیتهای انسانی را نمیتوان مستقیما از مطالعات مربوط به حیوانات بدست آورد. از آزمایشات انجام گرفته بر روی حیوانات ، میتوان به نتایج زیر پی برد:
- بافتهای جدید از هر نوع را میتوان با پرتودهی یک حیوان با حساسیت مناسب در شرایط پرتودهی متناسب معین تولید کرد.
- با پرتودهی حیوانات گونهها و نژادهای مختلف ، فراوانی انواع بافتهای جدید زیاد نمیشود.
- آثار سرطانزایی تابش از طریق ساز و کارهای متفاوتی که به نوع تومور و شرایط پرتوگیری بستگی دارد، به یکدیگر مربوط میشوند.
- در سطوح دوز پایین یا متوسط ، آثار سرطانزایی تابش اغلب ظاهر نمیشود، مگر عوامل دیگر به آن کمک کنند.
- توزیع تومورهای ناشی از تابش معمولا برحسب نوع تومور ، زمینه ژنتیکی و سن حیوانی پرتودیده ، شرایط پرتودهی و سایر متغیرها ، تغییر میکند.
نظریه دودمانی سرطانزایی
سرطان با سه ویژگی زیر مشخص میشود:
- تغییر شکل یاختهها که باعث بوجود آمدن یک حالت عدم پاسخگویی به ساز و کارهای کنترل رشد موجود زنده دست نخورده میشود.
- توانایی این یاختههای تغییر شکل یافته در تجاوز به بافتهای اطراف.
- توانایی این سلولها در مهاجرت به سایر نقاط بدن و بوجود آوردن یک تومور در حال رشد جدید ، نتیجه تغییر ارث بردنی در ماده ژنتیکی یک سلول بدنی است.
تائید تجربی توانمندی برای مدل دودمانی سرطانزایی وجود دارد. تغییرات کروموزومی ، نقش ترمیم DNA ، ترمیم خطا ، وراثت پذیری ویژگیهای تغییر شکل یافته در یاختههای بدنی ، همگی اگر دارای طرحهای یکسان نباشند، بسیار شبیه به الگوهایی هستند که در بروز سرطان ناشی از تابش ، دیده میشود. از تحلیل طرح تغییرات هم آنزیم داخل تومورها ، مدرکی قوی دال بر سازگاری و تداوم دراز مدت تغییرات نماد کروموزومی در سلول سرطانی و تولید طرحهای ایمنی گلبولی مخصوص که سرطان از یک تک یاخته بوجود آمده است، وجود دارد.
- تفاوتهای میان گونهای (یعنی مربوط به نژاد) در حساسیت به سرطانزایی ناشی از تابش پرتوها ، نقش مهمی را برای ساخت ژنتیکی نمونه پرتو دیده داراست. حالت تکثیر یاختهای و وابستگی حساسیت تولید سرطان به سن نیز ، دخالت تعیین کنندهای در این فرایند دارند.
نهفتگی رشد تومور
همه دادههای انسانی که ارزیابی شده است، به علاوه دادههای تجربی مربوط به حیوانات ، نشان میدهند که همواره تاخیری بین تابش نمونه و ظهور بافت جدید ، وجود دارد. برای جمعیتهای جونده ، نهفتگی در فاصله میان تابش و ظهور تومور میتواند از چند ماه سال (2 تا 3 سال) باشد. برای جمعیتهای انسانی ، نهفتگی میتواند به کوتاهی 2 الی 5 سال مانند
سرطانهای خون و یا به ازای 30 سال ، مانند برخی تومورهای سخت انسانی ، باشد. دلیل وجود این دوره نهفته مشخص نیست، اما وجود یک نهفتگی طولانی نشان میدهد که تغییرات چندی برای رشد نهایی تومورها یا در یاخته تغییر شکل داده و یا در ارتباط با میزبان این یاختههای تغییر شکل یافته ، ضروری است.
آثار آهنگ دوز
یک مشاهده کلی درباره سرطانزایی تابش این است که کاهش آهنگ دوز در فرایند پرتودهی ، تاثیر تابش در تولید سرطان را کم میکند. کاهش مشاهده شده در تاثیر کم کردن آهنگ دوز با قابلیت یاختههای پرتو دیده در ترمیم آسیب وارد بر مولکولهای DNA ارتباطی تنگاتنگ دارد. چون تاثیر بیشتر تابش با
LET بالا نیز به ترمیم یا عدم ترمیم DNA مربوط میشود، انتظار داریم تابشهای با LET بالا برای سرطانزایی موثرتر از پرتوهای با LET پایین باشند. کم کردن آهنگ دوز معمولا تاثیر تابش با LET پایین را در تولید سرطان ، کاهش میدهد.
سرطانزایی تابش در جمعیتهای انسانی
چند گروه از افراد پرتودیده برای ارزیابی گسترده سرطانهای پرتوزاد در دسترس هستند که در بین آنها گروههای زیر دارای اهمیت میباشند.
پرتوگیری شغلی
- پرتو شناسانی که در ضمن کار در معرض تابش قرار گرفتهاند.
- کارکنان معادن اورانیوم و سایر معادن که در محل کار خود در معرض تابش رادون (Ra) قرار گرفتهاند.
- رنگ کاران عقربههای رادیوم که در خلال رنگ کردن عقربههای شبرنگ در معرض رادیوم قرار میگیرند.
پرتو گیری پزشکی
- بیمارانی که برای خشک شدن مفصل ستون مهرهها ، با پرتوهای x یا رادیوم ، مداوا میشوند.
- زنانی که به خاطر درمان بیماریهای بیخطر ناحیه لگن و یا سینه تحت درمان هستند.
- نوزادان و کودکانی که به خاطر عوارض بیخطری چون غدههای تیموس بزرگ و یا کچلی مداوا میشوند.
- گروهی از کودکان که در هنگام حاملگی مادرشان در داخل رحم ، در معرض تابش قرار گرفتهاند.
سرطان پرتوزاد اندام خاص در انسانها
برآورد ضرایب خطر سرطانها در اندامهای به خصوص ، در حال حاضر در شرایط بازنگری پردامنهای است. حساسیت به بروز سرطان پرتوزاد به شدت تغییر میکند. نهفتگی بروز این بیماریها نیز دارای گستره وسیع تغییراتی از 5 سال برای سرطان خون تا 30 سال برای
سرطان سینه است. وقتی دادههای مربوط به بروز سرطان خون در بازماندگان ژاپنی و سایر گروههای تحت تاثیر اشعه ، ارزیابی شدند، نهفتگی کوتاه آن باعث شد که ناظران پیش بینی کنند مغز استخوان ، حساسترین عضو برای سرطان پرتوزاد است.
با گذشت زمان و بررسی سرطانهای پرتوزاد در سایر اندامهای بدن ، این دیدگاه تغییر چشمگیری کرده است. اکنون این باور وجود دارد که حساسترین اندامها به سرطان پرتوزاد عبارتند از: سینه زنان و
ریهها.
چهارشنبه 21/8/1393 - 16:39
دانستنی های علمی
دیدکلی:
مواد رادیواکتیو از اتم های ناپایداری تشکیل می شوند که تجزیه می شوند و انرژی سطح بالایی به نام تابش رادیواکتیو را آزاد می کنند این اتمها نهایتا عناصر جدیدی را تشکیل می دهند. سه نوع تابش رادیواکتیو وجود دارد که ذرات آلفا ، ذرات بتا ، و پرتوهای گاما خوانده می شوند.
اطلاعات اولیه:
پرتو آلفا (دو پروتون و دو نوترون): جرم چهار واحد اتمی (a.m.u) و بارالکتریکی مثبت در پرتو بتا (الکترونهای سریع): جرم ناچیز و بارالکتریکی منفی یک و پرتو گاما (موج الکترومغناطیسی): بدون جرم و بدون بار (مثلا انرژی خالص)
تاریخچه: حدود اواخر قرن نوزدهم اکثر دانشمندان بر این عقیده بودند که تمام مسائل عمده فیزیک حل شده اند ، به غیر از چند مورد جزئی برای قطعیت دادن به برخی نظریه های ضروری بود. در سال 1895 ، رزتگن اشعه ایکس را کشف کرد. این اشعه نخست در معاینات پزشکی به کار رفت و بعدها برای بررسی ساختمان اساسی مواد مورد استفاده قرار گرفت چند ماه بعد ماری کوری این پدیده جدید را رادیو اکتیو نامید. او و شورش پی یر کوری ، همچنین پولونیم (po ، فلز ضعیف) و رادیم (Ra ، فلز قلیایی خاکی) را کشف کردند. ماری کوری نخستین کسی بود که از اصطلاح «رادیواکتیو» برای موادی که فعالیت الکترومغناطی قابل توجه دارند استفاده کرد. خاصیت رادیواکتیویته این دو عنصر جدید از اورانیم بیشتر بود.
سیر تحولی و رشد:
ماری کوری تحقیق خود را با جستجوی کاربردهای پزشکی رادیواکتیو ادامه داد. و قدرت تشعشع ترکیبات اورانیم را اندازه گرفت و تحقیق خود را به عناصر دیگر از جمله توریم ، گسترش داد.
- در سال 1934 میلادی زوج ژولیو- کوری رادیواکتیویته مصنوعی را کشف کرد.
- ماری کوری پی یر کوری همراه با فیزیکدان فرانسوی هانری بکرل (1908-1852 م) مدل دیوی انجمن سلطنتی انگلستان و جایزه نوبل را در فیزیک برای کشف رادیواکتیو دریافت دریافت می کنند. پی یر کوری کشف می کند که رادیم Ra خود بخود حرارت آزاد می کند. این خاصیت نمود ثبت شده از انرژی اتمی به شکل گرماست.
در سال 1910 میلادی در کنفرانس بروکسل در مورد رادیواکتیویته ، واحد رادیواکتیویته به افتخار او کوری نامیده شد. در مورد کشف رادیواکتیویته توسط هانری بکرل باید بگوییم که در سال 1896 میلادی ، بکرل در جستجوی شواهدی بود که ثابت کند مواد شیمیایی که نور طبیعی فلوئورسان هستند از خود پرتو ساطع می کنند.
او یک نمونه سولفات پتاسیم اورانیم را برداشت و آن را همراه با یک صفحه عکاسی در کاغذ سیاه پیچید. از آنجا که روزی ابری بود. نمونه بکرل خاصیت فلوئورسانی را از خود نشان نمی داد. او آن را درکشویی در آزمایشگاه خود گذاشت و به آزمایشهای خود در مورد لامپهای اشعه کاتدی ادامه داد. چند روز بعد ، دریافت که نمونه تصویری را بر روی صفحه عکاسی ایجاد کرده است. این نشان می داد که ماده مذکور شکلی از تشعشع را که بعدا ماری کوری آن را رادیواکتیویته نامید ، از خود ساطع کرده است.1922 میلادی نیلز بور نظریه طیفهای ساختار اتمی را منتشر کرد و در 1927 میلادی اصل مکمل بودن را تنظیم می کند که رفتار پیچیده رادیواکتیویته را توصیف می کند.
ارنست رادرفورد فیزیکدان بریتانی نیوزلندی الاصل (1871-1937) بر روی رادیواکتیویته و ماهیت ذرات آلفا (دارای بار مثبت) تحقیق کرد و متوجه شد که بار مثبت اتم در مرکز آن و در هسته ای ریز و متراکم متمرکز است. در سال 1930 میلادی رادرفورد تشعشعات مواد رادیواکتیو را منتشر کرد.
تابشهای رادیواکتیو:
چنان که گفته شد سه نوع تابش رادیواکتیو وجود دارد که ذرات آلفا از چهار ذره اتمی ، یعنی دو پروتون و دو نوترون تشکیل می شوند. این ذرات ضعیفترین نوع تابش رادیواکتیو هستند. و بار الکتریکی مثبت دارند. مسیر آنها را می توان با صفحه کاغذ مسدود کرد. ذرات بتا قدرتمند و از ذرات اتمی که الکترون خوانده می شوند و بار منفی دارند تشکیل می شوند. این کاغذ عبور می کند ولی آلومینیوم آن را مسدود می کند. پرتوهای گاما از همه قدرتمند ترند. آنها امواج الکترومغناطیسی اند و فاقد بارالکتریکی می باشند. اما پرتوهای گاما را فقط لایه ضخیمی از سرب متوقف می سازد. خروجی یا تابش رادیواکتیو می تواند وارد بافتهای زنده شود و به آنها صدمه بزند. بنابراین اطراف آن باید کنترل شود. این تابش را با وسیله ای به نام شمارنده گایگر – مولر ، که نام آن از مخترعانش اقتباس شده است ، می توان اندازه گرفت. وقتی تابش رادیواکتیو وارد این شمارنده می شود ، گاز موجود در آن حامل الکتریسیته می شود. مقدار بار را می توان روی صفحه ای قرائت کرد یا از طریق یک بلند گو به صورت صداهای تیک تیک خاصی شنید.
نیمه عمر:
نیمه عمر یک ماده زمانی است که طول می کشد تا خاصیت رادیواکتیویته آن به نصف کاهش یابد. مثلا نیمه عمر کربن 14 (شکل خاصی از عنصر کربن) 5600 سال است. یعنی 5600 سال طول می کشد تا نصف اتم های رادیواکتیو کربن دچار فروپاشی شوند ، یا یک گرم از اتم های رادیواکتیو به نیم گرم تقلیل یابد. 5600 سال دیگر طول می کشد که همین مقدار نیز به نصف برسد و به همین ترتیب.
نیمه عمر عناصر مختلف از چند ثانیه تا میلیونها سال متغیر است. فروپاشی شبکه ای زباله های اتمی زیان بخش حاصل از نیروگاههای هسته ای میلیونها سال طول می کشد. و همه موجودات زنده روی زمین حاوی مقدار معینی کربن 14 (کربن رادیواکتیو) هستند که با تبادل مداوم گازهای اکسیژن و دی اکسید کربن بین موجودات زنده و جو زمین تشکیل می شود. وقتی یک گیاه یا حیوان می میرد ، این تبادل متوقف می شود و کربن 14 شروع به فروپاشی می کند.
دانشمندان می دانند که نیمه عمر این کربن 5600 سال است. بنابراین پس از این مدت جسم مرده دقیقا نصف تشعشع رادیواکتیو زمان زندگی خود را ساطع می کند. این فروپاشی با آهنگ ثابتی انجام می شود و در نتیجه این امکان وجود دارد که با اندازه گیری میزان تابش زمان مرگ موجود مورد نظر را دریافت. باستانشناسان از عمر بعضی کربن برای یافتن تاریخ مومیایی های مصر باستان استفاده کرده اند.
از دیدگاه نظری ، همه مواد رادیواکتیو نهایتا به سرب تبدیل می شوند ، هسته اتم سرب پایدار است و بنابراین خاصیت رادیواکتیو ندارد.اما این امر به طور تجربی اثبات نشده است. زیرا نیمه عمر بعضی از عناصر بیش از عمر انسانهاست.
عناصر متداول و نیمه آنها:
اورانیم 238 نیمه عمر آن 5 میلیارد سال
اورانیم 235 نیمه عمر آن700 میلیون سال
پلوتونیم239 نیمه عمر آن 24000سال
کربن 14 نیمه عمر آن 5600 سال
ید131 نیمه عمر آن 8 روز
طلای 198 نیمه عمر آن 3 روز
سدیم 24 نیمه عمر آن 15 ساعت
فلوئور 17 نیمه عمر آن 1 دقیقه
پولونیم 214 نیمه عمر آن00000003/0 ثانیه
سرب پایدار(بدون نیمه عمر)
کاربردها:
بسیاری از ایزوتوپها رادیواکتیو هستند یعنی ذرات با فرکانس بالا را از هسته (مرکز) اتمهای خود ساطع می کنند. از آنها می توان برای دنبال کردن مسیر مواد متحرکی که از دید پنهان هستند ، مانند جریان خون در بدن یک بیمار در بیمارستان ، استفاده کرد.
مقدار کمی از یک ایزوتوپ رادیواکتیو به درون جریان خون بیمار تزریق می شود. سپس مسیر آن توسط آشکار سازهای خاصی که فعالیت رادیواکتیویته را مشخص می کنند دنبال می شود. این اطلاعات به یک کامپیوتر داده می شود که صفحه آن هرگونه اختلالی مانند انعقاد خون در رگها را نشان می دهد. با استفاده از روشی مشابه ، می توان از ایزوتوپها برای مطالعه جریان مایعات در تاسیسات شیمیایی نیز استفاده کرد.
آهنگ فرسودگی ماشین آلات صنعتی را نیز می توان با استفاده از ایزوتوپها اندازه گرفت. مقادیر اندکی از ایزوتوپها رادیواکتیو به بخشهای فلزی ماشین آلات ، مانند یاتاقانها و رینگ پیسونها اضافه می شود. سپس سرعت فرسودگی با اندازه گرفتن رادیواکتیویته روغنی که برای روغنکاری این بخشها به کار رفته است محاسبه می شود.
اندازه گیری رادیو اکتیویته
خروجی یا تابش رادیواکتیو می تواند وارد بافتهای زنده شود و به آنها صدمه بند ، بنابراین اطراف آن باید کنترل شود . این تابش را با وسیله ای به نام شمارنده گایگر ـمولر ، که نام آن از مخترعانش اقتباس شده است ، می توان اندازه گرفت وقتی تابش رادیو اکتیو وارد این شمارنده می شود ، گاز موجود در آن حامل الکتریسیته می شود . مقدار بار را می توان روی صفحه ای قرائت کرد ، یا از طریق یک بلندگو به صورت صداهای تیک تیک خاصی شنید.
چهارشنبه 21/8/1393 - 16:38
اطلاعات دارویی و پزشکی
| تابش پرتوها بر موجودات زنده دارای دو اثر است: آثار تصادفی ، آثار غیر تصادفی آثاری هستند که برای آنها یک آستانه دوز (مقدار تابش) وجود دارد. از آثار غیر تصادفی ، آثار دیررس پرتوی تابشها را بر روی بافتها و اندامهای مختلف بدن را میتوان نام برد. |
اطلاعات اولیه
آثاری که برای آنها به نظر میرسد رابطه دوز - پاسخ دادن یک آستانه دوز است. هر شخص دریافت کننده ، اگر از این دوز آستانه تجاوز کند، احتمالا بزودی تاثیر گذاشته می شود. با در نظر گرفتن تغییر پذیری بیولوژیکی ، به عنوان آثار غیر تصادفی پرتوها ، تعریف میشود. یکی دیگر از مشخصههای این طبقه از آثار غیر تصادفی از این قرار است که معمولا یک مقیاسی شدت همراه با دوز وجود دارد و افزایش دادن دوز دریافتی توسط شخصی که هدف تابش است، انتظار میرود که شدت نتیجه را برای آن شخص افزایش دهد.<br><br>آثار غیر تصادفی تابش بر بافتها و اندامها ، پاسخهای بافتهایی هستند که چندین هفته تا چندین ماه پس از تابش گیری ، مشاهده آنها آغاز میشود. دوزهای لازم برای ظاهر شدن این پاسخهای تاخیری غالبا ممکن است پردامنه از دوزهای مربوط به اکثر پاسخهای حاد و زودرس باشند و به همین دلیل اغلب با تابش منطقهای در نوع آینه
پرتو درمانی برای بیماریهای بدخیم تجویز میکنند، مشاهده میشوند. بیماران اغلب با دوزهای تابشی تمام بدن در ترازهای دوزی که معمولا با شروع آثار در این پاسخ تاخیری بافتها توام است، دوام نمیآورند.
دستگاه معدی - رودهای
مری
مری ساختاری لولهای با عضله مخطط و بافت درونی آن به صورت فلسدار ، چند لایه و دارای
بافت پیوندی شل است. فعالیت مری انقباض است. آستر بافت درونی نسبتا سریع تجدید شده است و به تابش حساس میباشد و در نتیجه پس از دریافت دوزهای بالای پرتو ، از بین میرود. این پاسخ نسبتا فوری آستر را میتوان به عنوان پاسخ حاد یا زودرس در نظر گرفت.
معده
پاسخهای زودرس آستر معده به پرتوها ، تا حد زیادی بستگی به تغییراتی دارد که در نتیجه آثار کشش یاختهها روی سلولهایی که فعالانه تقسیم میشوند، رخ میدهد. معده پس از دوزهای متوسط پرتو گیری به سرعت به حالت عادی باز میگردد. هر چند که کاهش فعالیت ترشحی ممکن است، ماهها و سالها پس از پرتو تابی ، آشکار شود. آثار دیررس در معده بیشتر آثاری هستند که میتواند از نارسایی عروقی ناشی شوند. پیشرفتی از تصلب بافتهای بینابینی سرخرگهای موئینه تا فیبرو آتروفی گسترده وجود دارد. نشانگان دیررس برای معده به صورت
فیبروآترفی مخاط معدی - کاهش تحرک معده - از دست رفتن توان اتساع و تنگی آشکار توصیف شده است.
روده کوچک و بزرگ
رودههای کوچک و بزرگ از نظر کالبد شناختی به هم شبیه هستند جز در مورد پرزها که روده بزرگ فاقد پرز است. تغییرات بافت عروقی و همبند در پاسخهای دیررس تمام اجزای روده ، غالب هستند. نخستین پیشگام مرئی آثار دیررس در روده عبارت از تغییر یاختههای درون پوش در روده کوچک ، همراه با لختههای گسترده است. این تغییرات ضخیم شدن لیفی بافتهای زیر مخاطی ، نارسایی عروقی و فیبروآتروفی عمومی هستند. در اینجا هم ممکن است تنگی یا انسداد کامل رود با پیش آید.
راست روده یا رکتوم
راست روده عبارت است از امتداد تخصص یافته روده بزرگ که کار آن ذخیره و دفع مدفوعهای تشکیل شده است. این اندام در پرتو درمانی از اهمیت خاصی برخوردار است، زیرا غالبا برای تومورهای قسمت تحتانی شکم ، مانند مثانه ، رحم ، پروستات در میدان تابش قرار میگیرد. آسیب شدید و دیررس راست روده نیز به صورت تغییرات لیفی شدگی گسترده است و به تنگی یا انسداد کامل میانجامد. به علاوه به علت ویژگیهای قسمت زیر مخاطی این عضو ، نازک شدن و سرانجام سوراخ شدن راست روده یکی از عواقب احتمالی پرتو تابی ، به شمار میآید.
پوست
بخشی از پوست به سرعت جایگزین و نوسازی میشود، در پوست یا
اپیدروم است که از یک لایه یاخته پایهای تشکیل میشود و در حکم مخزن پایه برای یاختههای در پوست که دائما پیر میشوند، عمل میکند. سرنوشت نهایی این یاختهها از این قرار است که شاخی شده ، پوسته پوسته شده میریزند.<br><br>قسمت باقیمانده پوست به عنوان اندام بشره است که لایه بافتهای همبند سست به شمار میآید که دارای عروق خونی فراوانی است. پایههای مو و غدههای چربی به بشره نفوذ میکنند. آثار دیررس پرتودهی پوست ، بیگمان به علت تغییرات ساختار ریز عروقی لایه پوستی زیر بشره است. ضایعات دیررس تابش ناشی از تغییرات گسترده شبکه عروقی پوستی به نازک شدن و حتی بافت مردگی بشره پوست در دوزهای بالاتر منجر میشود.<br><br>در بعضی موارد تغییرات لیفی گسترده لایه بشره به تشکیل زخم در میدان تابش میانجامد. در بین تغییرات ،
التهاب چرخهای و
تصلب غشا و نارسایی عروقی شناسایی میشود که به تغییرات غیر قابل بر گشت نهایی منجر میشود.
کبد
کبد را از دیر باز اندامی مقاوم در برابر تابش دانستهاند. مشاهدات انجام شده روی بیماران نشان داده است که آثار دیررس پرتو دهی کبد میتواند مهم و تهدید کننده حیات باشد. واکنش از طریق وارد آمدن آسیب بر عروق ریز کبد ، بروز میکند. این که آیا این آسیب بر ساختار ریز عروقی عامل تسریع کننده به شمار میآید یا اینکه ، به نوبه خود ، پیامد وارد آمدن آسیب در سطح دیگری است. نمیتوان نشان داد، اما منطقی که گمان کنیم الگوی کلی تخریب یاختههای درون پوش ساختار ریز عروقی در اینجا نیز دخالت دارند.<br><br>
هپاتیت ناشی از تابش واقعیتی متمایز است که معمولا از قرار گرفتن غیر قابل اجتناب کبد در میدان تابش در حین بسیاری از پرتو درمانیها پیش میآید. تغییرات آسیب شناختی بافتی مشاهده شده در این مورد عبارتند از ، انسداد سیاه رگهای کوچک کبدی که به پرخونی کبدی میانجامد. پس از زمانهای خیلی زیاد پس از پرتو دهی ، تغییرات شدید لیفی شدن کبد میتواند با دوزهای چشمگر تابش از لحاظ بالینی مشاهده شود. نارسایی کبد و هپاتیت و آب آوردن شکم در مورد بیمارانی که کبدشان بر اثر
پرتو درمانی دوزهای بالا دریافت کرده ، گزارش شده است.
کلیهها
حساسیت کلیه نسبت به دریافت تابش شناخته شده است در بیمارانی با تغییرات تباه کننده پیشرفته در کلیه ناشی از پرتو تابی ، به ایجاد بیماریی میانجامد که به آن
تصلب سرخرگی کلیه میگویند. این حالت بیماری تغییر لیفی و تصلبی پیشرفته سرخرگهای کوچک و مویرگهای تامین کننده خون برای
گلومرول کلیه است که به تغییرات تصلبی گلومرول و از دست دادن ظرفیت کارکرد آن در تصفیه پلاسمای خون میانجامد که در حکم نخستین مرحله فرایند تشکیل او را ضروری است. تغییرات تصلبی به بروز اختلال در کار کلیه ، منجر به افزایش
فشار خون و کم خونی ناشی از نارسایی کلیه میشود.<br><br>حتی قبل از اینکه تغییرات تصلبی چشمگیری رخ دهد، بطوری که از
آسیب شناسی میکروسکوپیکی بر میآید، تغییرات بسیار زیادی هم در کارکرد گلومرولی و نیز جذب مجدد لولهها پدید میآید. پر ادراری گزارش شده از سوی دانشمندان ، نشانه اختلال چشمگیری در لولههاست که به اختلالات عروقی ربطی ندارد. این پر ادراری در همان زمانی رخ میدهد که سرعت صاف کردن لولهای سریعا کاهش یافته است. بنابراین علی رغم حجم کوچکتر
پالایش پلاسما که برای عمل آوری در لولهها بروز یافته است، مقدار ادرار خروجی نهایی روزانه افزایش مییابد.
ریه
ریه از اندامهای پیچیده و بسیار پر عروق است که به علت کارکرد خاصاش ، در یک محیط مخلوط هوا - مایع ، عمل میکند. ریه بطور کلی ، بافتی است تجدید نشونده با استثناهایی که در یاختههای تخصص یافته ریه، یافت میشود. یکی از آثار دیررس پرتو گیری ریهها عبارت است از ورم ریه ناشی از تابش. پس از بهبود ورم ریه ناشی از تابش ، اگر این امر در دوز مصرف شده ممکن باشد، بسیار متفاوت در زمانی به مراتب دیرتر بروز میکند.<br><br>در صورتی که آغاز ورم ریه در مدت زمانی 3 - 6 ماه است و در موش بهبودی یا مرگ در ظرف حدود 6 ماه اتفاق میافتد، پس از حدود یک سال ، مرحله دومی از آسیب ظاهر میشود. بافت بحرانی درگیر در این آسیب دیررس ریه شناخته نشده است. این آسیب مرحله اخیر با سایر آثار دیررس در دیگر اندامها ، یعنی در عوارض تصلب بافتها ، التهاب ، شاخی شدن و از دست رفتن خاصیت ارتجاعی مشترک است.
دستگاه اعصاب مرکزی
مغز اندامی شگفت انگیز است که اطلاعات درباره واکنش دیررس و تاخیری مغز به پرتو دهی بسیار محدود است. درباره وجود آثار تاخیری حاصل از پرتودهی به مغز ، تردیدی وجود ندارد. بافت مردگی مغز ناشی از تابش به عنوان پیامدی به درمان بیماریهای بدخیم در مغز به نحو پردامنهای گزارش شده است. بعضی گمان میکنند که بافت مردگی حاصل تغییرات عروق ریز ، خیلی شبیه به آنچه در اندامهای دیگر پیش میآید، است. ظاهرا مدت کوتاهی پس از پرتو دهی ، یک اختلاف درصد مابین
خون و
مغز ظاهر میشود که به ضایعه ورم مغز میانجامد. این اثر بطور کلی قابل برگشت است، در صورتی که دوز تابش خیلی بالا نباشد.
چشم
آب مروارید زایی
از جمله اجزای کالبد شناختی چشم ، فقط عدسی از لحاظ حساسیت به تابش مهم است. انواع
آب مروارید که به صورت تغییرات قابل آشکار سازی در قالب سرشت نیمه شفاف عدسی تعریف میشود، به عنوان حاصل تابش
پرتوهای یونساز در سال 1946 گزارش شد. این نخستین رویداد گزارش شده از بروز آب مروارید زایی ناشی از قرار گرفتن در معرض پرتوها بود. عدسی ساختاری دارد که در آن ذخیره خونی وجود ندارد که مواد مغزی و اکسیژن را برای فرآیندهای اکسایشی عادی سوخت و سازی تامین کند و مواد غذایی و اکسیژن بایستی از طریق انتشار وارد آن شوند. عدسی از جمعیت یاختههای دودمان زایی برخوردار است که به آهستگی تجدید میشوند، و به هر طرف عدسی مهاجرت میکنند تا الیاف عدسی را تشکیل دهند.<br><br>وقتی در معرض تابش قرار گیرد، محصولات تقسیم یاختهای آسیب دیده در حین مهاجرت تحت تاثیر تمایز غیر موثر واقع میشوند و نمیتوانند به تراز نیمه شفافی ضروری برای عمل عدسی به صورت یک وسیله اپتیکی دست یابند و نقایصی رادر انتقال نور باعث میشوند که در هنگام معاینه به صورت آب مروارید دیده میشود. آب مروارید یکی از تغییرات دیررس تابش است که به روشنی مربوط به تغییرات تباه کننده در آدوتلیم عروقی نیست، زیرا هیچ بافت عروقی در این اقدام وجود ندارد. تقریبا با اطمینان میتوان گفت که این باید از وارد آمدن آسیب به یاختههای اپیتلیال دودمان زایی عدسی چشم حاصل نشود که به تغییر ناقص در یاختههای نسل بعدی میانجامد.
چهارشنبه 21/8/1393 - 16:38
اطلاعات دارویی و پزشکی
| مواد یا هستههای پرتوزا از چند راه مختلف وارد بدن شده و در آنجا تهنشین میشوند و در بدن فرآیندهایی را موجب میشوند. |
 |
| علامت مشخصه رادیواکتیویته |
دید کلی
هستههای پرتوزایی که بر اثر فرآیندهای سوخت و سازی یا به راههای دیگر وارد یاخته زنده میشوند، دوز جایگزین شدهای را بوجود میآورند که ممکن است بسیار بالا و از لحاظ کیفی با دوز دریافتی از چشمهای خارجی متفاوت باشد. چون اغلب این هستههای پرتوزای تهنشین شده ، چشمههای تابش با
LET (انتقال خطی انرژی) بالایی هستند، فقط در شرایط نسبتا غیر عادی سیستمهای زنده ، مخصوصا انسانها در معرض تابش با
LET بالا از چشمههای خارجی قرار میگیرند.
چنین شرایطی میتواند شامل پرتو گیری شغلی در حوالی شتابگرهای بزرگ تجربی ، یا پرتو گیری شغلی فضانوردان از ذرات باردار سنگین پُرانرژی موجود در فضای ماورای زمین باشد. وقتی هستههای پرتوزا وارد سیستم زنده میشوند، تابشهای
LET بالای ناشی از
واپاشی آنها ، اهمیت پیدا میکند. مثلا وقتی ذرات آلفا از سیستمهای زنده خارج هستند، نمیتوانند دوز قابل ملاحظهای را به یاختههایی تحویل دهند که پس از جذب در بدن در آنها جایگزین میشوند.
مسیرهای ورود هستههای پرتوزا
سرنوشت سوخت و ساز هر هسته پرتوزا ، این حقیقت را تغییر نمیدهد که این هسته میتواند واپاشیده و انرژی آزاد کند. مسیر آن در هر سیستم فعال سوخت و سازی یاخته اندام یا انسان را واکنش پذیری عنصر مادر و واکنش پذیری شکل شیمیایی و فیزیکی آن تعیین میکند. منظور از حالت اخیر ،
انحلال پذیری ،
حالت والانس ،
شکل نمکی و
محیط شیمیایی که جسم در آن قرار دارد، مانندPH محیط است.
برای یادآوری پیچیدگی مسیرهای منتهی به جایگزینی پرتوها در اندامی از بدن انسان ، مثال مسیرهای زیست شناختی ید و ایزوتوپهای آن به اختصار بیان میشود.
- عنصر ید موجود در محیط میتواند از سادهترین راه موجود ، یعنی از راه استنشاق نوکلوئید وارد بدن شود. نوکلوئید ضمن حرکت در سطح حفرهدار ریه ، به جریان خون وارد میشود، طبق مسیرهای سوخت و سازی متداول ، ید یا یدید موجود در خون توزیع میشوند. مسیر استنشاق ورودی ، جز در شرایط غیر عادی و محدود ، از کمترین اهمیت برخوردار است.
- مسیر دیگر ، بلعیدن است. ید موجود در افشانهها یا ید آزاد در حالت بخار را گیاهان سبز ، با رسوب در سطح برگها یا انتقال سوخت و سازی به داخل محتویات یاختهای جذب میکنند. انسان میتواند این سبزیها را بخورد که به جذب آن از طریق فرآیندهای عادی معدی - رودهای میانجامد. آنچه اهمیت بسیار بیشتری دارد، خوردن شیر حیوانات اهلی است. گاو مقدار زیادی علف سبز میخورد و ید جذب شده از این مواد غذایی در شیر ظاهر میشود.
آیا گوشت حیوانات اصلی هم چشمه مهمی از نوکلوئیدهای ید به شمار میآید؟ پاسخ منفی است، زیرا تمام رادیو نوکلوئیدهای ید ، کوتاه عمر هستند. قبل از اینکه گوشت وارد زنجیره مصرف شود، بر اثر پرتوزا ، از بین میروند.
- مسیر سومی نیز وجود دارد اما این مسیر ، معمولا خالی از اهمیت است. این مسیر تزریق است. ورود مستقیم نوکلوئید به جریان خون وقتی صورت میگیرد که در پزشکی هستهای برای مقاصد تشخیصی یا درمانی از هستههای پرتوزا ، بهره میگیرند. دیگر از صورتهای تزریق با نفوذ تصادفی مواد دارای آلودگی سطحی با هستههای پرتوزا در پوست است. این امکان معمولا به کاربردهای مواد پرتوزا ، در حوزه کارهای شغلی مربوط است.

بخشهای تبادل مواد پرتوزای ورودی به بدن
چهار بخش اساسی بدن وجود دارد که در آنجا تبادل مواد پرتوزای ورودی به بدن صورت میگیرد:
- ریهها و دستگاه تنفسی فوقانی
- دهان و دستگاه معدی - رودهای
- دستگاه جریان خون شامل قلب و کلیه
- دستگاه جریان لنفاوی همراه با گرههای لنفاوی وابسته
مسیر تزریق که ذکر شد، جز در موارد خاص ، اهمیت چندانی به عنوان مسیر رودهای هستههای پرتوزا ندارد. تزریق ، بسادگی ، هستههای پرتوزا را وارد
جریان خون میکند. سایر مسیرهای ورودی ، بلعیدن و استنشاق ، اساسا عامل ورود ناآگاهانه هستههای پرتوزا به بدن بشمار میآیند.
بلعیدن
- موادی که به صورت محلول یا نامحلول به حفره دهانی راه مییابند، پس از ورود از طریق دهان ، خارج نمیشوند. علاوه بر آنچه مستقیما وارد حفره دهان میشود، بخش ناشی از فعالیت پاکسازی بخشهای فوقانی درخت نای - نایژهای نیز به آن افزوده میشود. ذراتی که از طریق بینی یا دهان وارد دستگاه تنفسی میشوند، بر حسب اندازه ، در دیوارههای ناحیه نای - نایژه فوقانی رسوب میکنند یا به ریه وارد میشوند.
- ذراتی که در ناحیه نای - نایژه فوقانی تهنشین شدهاند، بر اثر عمل مُژکی که در سطوح مجرایی بخش فوقانی این اندام به وقوع میپیوندند، به طرف بالا رانده میشوند. این مواد وارد دهان و پس از ورود به ماده مخاطی معمولا قدرت داده میشوند. این مواد قسمت عمده ای از بار بلعیدنی را تشکیل میدهند، به خصوص هنگامی که پرتودهی در محیط شدیدا غبار آلود یا در هوای مرطوب صورت گیرد.
- مواد پرتوزا پس از بلعیدن همان مسیر عادی سایر موادی را که از دستگاه نای - نایژه میگذرند، دنبال میکنند. مهمترین نکته در تعیین مقدار هستههای پرتوزای جذب شده از بلعیدن ، انحلال پذیری آنها در محیط شیمیایی دستگاه گوارش است که در معده شدیدا" اسیدی و در روده کوچک فوقانی ، قلیایی است. هر چیزی که در سطوح معده - رودهای منتقل نشود، سرانجام از طریق فضولات دفع میشود.
- جذب از دستگاه معدی - رودهای میتواند مستقیما به دستگاه گردش خون یا با احتمال کمتر به جریان لنفاوی صورت گیرد. یکی از مشکلات مسیر معدی - رودهای عبارت است از احتمال ترشح صفراوی حاوی هستههای پرتوزای گردآوری شده از یکی از مسیرهای گردش یا هر دوی آنها در کبد به داخل دستگاه معدی - رودهای.

استنشاق
- برای ملاحظه ترابرد و جایگزینی هستههای پرتوزا در بدن انسان میتوانیم دستگاه تنفس را به سه ناحیه تقسیم کنیم که دارای ویژگیهای کاملا متمایزی برای نگهداری مواد ورودی به آن ، بدون توجه به پرتوزا بودن یا نبودن آنها هستند. این نواحی عبارتند از:
مجراهای بینی (Nasal Passages) ، درخت نای - نایژهای (tracheobrancheal tree) و پارانشیم عمق ریه. نفوذ مواد موجود در هوا به این نواحی را خواص آئرودینامیکی ذرات استنشاق شده ، تعیین میکند.
- پس از نفوذ ذرات هوابرد کوچکتر به ریه و تهنشینی در سطوح مجاور هوای ریه ، سرنوشت نهایی ماده پرتوزایی که مثلا پس از خوردن به ذره ملحق شده است، به حالت شیمی فیزیکی ماده ، بستگی دارد. موادی که در PH اساسا خنثی سطوح ریه محلول هستند، به سرعت در محیط آبی آن حل میشوند و با انتقال در دیواره خانهخانهای آن به سیستم آوندی میروند. فراوانی کاهندههای فشار سطحی موجود در سطح ریه ، این فرآیند را عملا آسان میکند.
- اگر ماده پرتوزا نامحلول یا به صورت اندکی محلول و به صورتی باشد که محیط سطح ریه نتواند آن را تغییر دهد، بیگانهخواری ریه آن را از بین میبرند. این ذرات بیگانهخواری شده سرانجام در گرههای لنفاوی مجاور مستقر میشوند. ذره برای مدتی در این مکان باقی میماند. اگر رادیو نوکلوئید تهنشین شده در گره لنفی اندکی محلول باشد، بخش محلول آن در هنگام عبور از گره به لنف منتقل میشود.
سرانجام لنف گرد آوری شده ، در جریان آوندی تخلیه و ماده محلول ، طوری توزیع میشود که گویی مستقیما به جریان خون وارد شده است. سوخت و ساز هستههای پرتوزایی که از طریق تنفس به بدن وارد شده اند، وقتی وارد سیستم آوندی شوند، به صورت هستههای پرتوزایی است که از طریق مجرای معدی - رودهای جذب شدهاند.
چهارشنبه 21/8/1393 - 16:38
اطلاعات دارویی و پزشکی
| ماده نرم قرمز یا زرد رنگی است که مجرای میانی استخوان یا حفرههای بافت اسفنجی را پر میکند. مغز استخوان از بافت پیوندی است که در آن سلولهای چربی فراوان و سلولهای پیوندی و تارهای پیوندی و مویرگها و سلولهایی بنام میلوگونی وجود دارد. میلوگونیها مولد گلبولهای قرمز و گلبولهای سفید هستند. |
مقدمه
در اسکلت آدمی سه نوع استخوان ، پهن و کوتاه و دراز وجود دارد. هر سه نوع استخوان از بافت استخوانی درست شدهاند و پردهای به نام ضریع آنها را میپوشاند. بافت استخوانی از سلولها و بخش زمینهای که بین سلولها را پر میکند درست شده است. بافت استخوانی به دو صورت بافت متراکم و اسفنجی وجود دارد. بافت استخوانی متراکم مانند تنه استخوانهای دراز از مجموعههایی به نام سیستم هاورس درست شده است.
در هر سیستم هاورس یک مجرا و تیغههای استخوانی متحدالمرکز وجود دارد. در مجرای هاورس رگهای خونی و اعصاب وجود دارند. در بافت اسفنجی تیغههای نامنظم استخوانی دیده میشود که در حفرههای وسط آنها مغز استخوان و رگهای خونی قرار دارند. ضریع پردهای است پیوندی ، مرکب از دو لایه و همین لایه ضریع است که رشد قطری استخوان را سبب میشود.
انواع مغز استخوان
مغز استخوان بافت نرم و پرعروقی است که داربست آن را بافت رتیکولر تشکیل میدهد و بر روی آن سلولهای مختلف خونی ، خونساز و چربی قرار دارد. مغز استخوان حفره مرکزی استخوانهای دراز و فضاهای بین ترابکولی استخوانهای اسفنجی را پر میکند. مغز استخوان به دو صورت
مغز قرمز و
مغز زرد دیده میشود که اولی عمدتا از سلولهای خونساز تشکیل شده و
بافت میلوئید نیز خوانده میشود و دومی عمدتا حاوی سلولهای چربی است.
در مرحله جنینی و پس از تولد تا مرحله بلوغ همه استخوانها حاوی مغز قرمز میباشند ولی در بزرگسالان مغز قرمز محدود به مهرهها ، استخوانهای جناغ ، دندهها و استخوانهای جمجمه میباشد و در بقیه جاها با مغز زرد جایگزین میشود.
عملکرد مغز استخوان
اصولا تمام مغز استخوانهای بدن تا دوران بلوغ خونسازی میکنند اما مغز استخوان دراز بعد از سن بیست سالگی به بافت چربی تبدیل شده و دیگر عمل خونسازی را انجام نمیدهد. از این پس فقط مغز استخوانهایی نظیر مهرهها ، جناغ سینه ، دندهها عمل خونسازی را انجام میدهند. به تدریج که سن زیاد میشود قدرت سازندگی مغز استخوان نیز کاهش مییابد و در سنین پیری کم خونی مختصری نمایان میگردد. مغز استخوان در واقع جزء دستگاههای خون ساز بدن محسوب میشود.
در بزرگسالان اندام خونساز مغز استخوان است اما در جنین کبد نیز به این کار اشتغال دارد. در چند هفته اول زندگی جنین گلبولهای سرخ در کیسه زرده ساخته میشوند و در اواسط آبستنی عضو اصلی سازنده گویچه سرخ کبد است. در عین حال تعداد قابل ملاحظهای گلبول قرمز نیز توسط طحال و غدد لنفاوی ساخته میشود. در ماههای آخر آبستنی و پس از تولد گلبولهای قرمز اساسا بوسیله مغز استخوان ساخته میشود.
سلولهای مغز استخوان
در مغز استخوان سلولهایی به نام سلولهای ریشهای چند ظرفیتی وجود دارد که دو نوع سلول از آنها جدا میشود.
- سلولهای رده لنفوئیدی که لنفوسیتهای نوع B و T را میسازند.
- سلولهای رده میلوئیدی که این سلولها در مسیر تکاملی خود تبدیل به چندین نوع سلول میشوند. این سلولها از آن جهت که در محیط کشت قادر به تشکیل کلنی هستند به نام واحدهای کلنی ساز (CFU) شناخته میشوند این سلولها عبارتند از:
- سلولهای کلنی ساز که رده مگاکاریوسیتی را میسازند و در نهایت پلاکتها را بوجود میآورند.
- سلولهای کلنی ساز که ردههای گرانولوسیت و مونوسیت را میسازند.
- سلولهای کلنی ساز که رده ائوزینوفیلی را میسازند.
- واحد کلنی ساز سازنده رده بازوفیلی.
- واحد کلنی ساز که رده اریتروئیدی را میسازند. این سلولها در نهایت گلبولهای قرمز را بوجود میآورند.
دودمان گلبول قرمز
گویچههای سرخ از سلولهای اولیهای به نام پرواریتروپلاست بوجود میآیند. واحد کلنی ساز رده اریتروئیدی طی سپری شدن مراحلی که نامعلوم است و در اثر عاملهای رشد مختلف به پرونورمربلاست تبدیل میشود که اندازه بزرگ و هسته بزرگ دارد. این سلول سپس به مزومربلاست بازوفیلی که اندازه و هسته کوچکتری دارد تبدیل میشود. ساخته شدن هموگلوبین در این سلولها شروع میشود این سلولها به نورموبلاستهای پلی کروماتوفیلیک که نسبت به نورموبلاستهای بازوفیلی اندازه کوچکتر و هسته کوچکتری دارند تبدیل میشوند.
هسته در این سلولها چروکیده شده ولی ساخته شده هموگلوبین ادامه مییابد و سیتوپلاسم دچار چند رنگی است. چند رنگی به علت اختلاط رنگ بازوفیل و هموگلوبین است و اصطلاح پلی کروماتوفیلی از همین جا ناشی میشود. سلولهای فوق به نورموبلاستها تبدیل میشوند و سرانجام پس از اینکه سیتوپلاسم سلولهای نورموبلاست از هموگلوبین اشباع شد هسته را از دست داده و به سلولهای رتیکولوسیت تبدیل میشوند. رتیکولوسیتها دارای منظره مشبک هستند و به همین دلیل رتیکولوسیت نامیده میشوند.
رتیکولوسیتها که واجد عمل هموگلوبین سازی هستند بزرگتر از اریتروسیتها بوده و با عمل دیاپدز از دیواره مویرگها عبور میکنند و وارد جریان خون میشوند. رتیکولوسیتها سپس تبدیل به اریتروسیتها یا گلبولهای سرخ میگردند. تعداد رتیکولوسیتها در خون نشانه میزان تشکیل اریتروسیتها در مغز استخوان است. اریتروپوئز یا بلوغ گلبولهای سرخ بطور طبیعی به وجود موادی نظیر
ویتامین B12 و
اسید فولیک نیازمند است.
عوامل موثر در خونسازی
نقش ویتامین B
12 بیشتر از اسیوفولیک است و موسوم است به عامل خارجی خونسازی موجود در آن را در محیط خارج و از طریق غذا دریافت میکند و ویتامین B
12 یا عامل خارجی فقط در حضور یک موکوپروتئین به نام عامل خونسازی داخلی که از غدد معدی ساخته میشود جذب میگردد. کمبود ویتامین B
12 و یا عامل داخلی سبب عدم بلوغ گویچهها سرخ شده و بدین ترتیب سلولهای نابالغی با عمر کوتاه گردش میکنند.
چهارشنبه 21/8/1393 - 16:37
اطلاعات دارویی و پزشکی
| اشعههایی که بر روی موجودات زنده تاثیر میگذارند اشعههایی هستند که توانایی یونیزاسیون مواد بیولوژیکی را در صورت نفوذ به داخل آنها دارند. این اشعهها به اشعههایی یونیزه کننده غیر مستقیم و مستقیم ، تقسیم بندی میشوند. |
اطلاعات اولیه
اثر اشعههای یونیزه کننده غیر مستقیم مانند پروتون ، الکترون و ذره آلفا ، بر روی مواد بیولوژیکی عمدتا از طریق برخورد با الکترونهای اتمها یا مولکولهای ماده میباشد. نتیجه این برخوردها ایجاد الکترونهای سریعالسیر میباشد. الکترونهای حاصله میتوانند در داخل ماده حرکت نموده و با توجه به این که دارای بار الکتریکی میباشند، ایجاد یونیزاسیون و تحریک در اتمها شوند و به این طریق الکترونهای حاصله میتوانند موجب تاثیر بیولوژیکی یا شیمیایی شوند.
اشعههای یونیزه کننده مستقیم نیز به علت آن که دارای بار الکتریکی هستند، از همان ابتدای ورود به ماده ، باعث
یونیزاسیون و تحریک اتمهای مواد بیولوژیکی میشوند. بنابراین در نهایت هر دو نوع اشعه دارای تاثیر یکسانی میباشند. مقدار یونیزاسیون و تحریک حاصله در طول مسیر ذره بستگی به نوع ذره باردار ، انرژی ذره و همچنین نوع مادهای که ذره به داخل آن منتقل میشود، دارد. مراحل مختلف تاثیر اشعه به صورت زیر است:
مرحله تاثیر فیزیکی ،
مرحله تاثیر فیزیو شیمیایی ،
مرحله تاثیر شیمیایی و بالاخره
مرحله تاثیر بیولوژیکی که مدت زمان این تاثیر میتواند از یک میلیونم ثانیه تا چند سال باشد.
تاثیر اشعه بر روی سلول
واحد ساختاری موجودات زنده ،
سلول است. از اجتماع سلولهای همشکل و همکار ، بافتها تشکیل میشوند. اثری که اشعه بر روی یک دسته سلول بخصوص دارد با اثری که بر روی دسته دیگر میگذارد، متفاوت است. تاثیر اشعه بر روی سلولهای کبدی باعث افزایش ذخیره گلیکوژن آنها میگردد.
لنفوسیتها سلولهای بسیار حساس در مقابل اشعه هستند. سلولها را میتوان از یک جهت که قابلیت ترمیم خود را دارند یا قابلیت ترمیم ندارند، تقسیم بندی کرد. سلولهایی که قابلیت ترمیم ندارند مانند سلولهای عصبی در مقابل اشعه مقاومتر هستند.
تاثیر اشعه در مراحل مختلف چرخه سلول
حساسیت سلولها نسبت به اشعه در مراحل مختلف تقسیم سلولی متفاوت است. تحقیقات نشان داده که سلولهایی که در حال
میتوز هستند دارای حساسیت بیشتری نسبت به اشعه هستند. پس از آن سلولهایی که در شروع
مرحله S (همانند سازی DNA) هستند دارای بیشترین حساسیت نسبت به اشعه هستند. کمترین حساسیت نسبت به اشعه را سلولهایی دارند که در شروع
مرحله G1 (وقف اول) و
G2 (وقفه دوم) واقع هستند. بیشترین مقاومت سلولها در مقابل اشعه در مرحله انتهای S میباشد. از این ویژگی میتوان برای همفاز نمودن سلولها در محیط کشت استفاده کرد.
تاثیر اشعه بر روی کروموزومها
اشعه ممکن است موجب پارگی یک یا چند رشته کروموزوم در یک یا چند نقطه شود. تغییرات بعد از پارگی عبارتند از:
- ترمیم: منظور از ترمیم برگشت کروموزوم به حالت قبل است. اغلب وقتی اتفاق میافتد که فاصله بین قسمتهای قطع شده بهم ، نزدیک است.
- تغییر مکان (Translocation): این وضعیت زمانی اتفاق میافتد که قطعات پاره شده بهم بچسبند و یک قطعه از یک کروموزوم به یک کروموزوم دیگر متصل شود. این تغییر موجب تغییراتی در سلول یا مرگ سلول میشود.
- معکوس شدن (Inversion): ممکن است قطعه پاره شده کروموزومی معکوس شود و سپس به همان منطقه قطع شده متصل شود.
حساسیت بافتها نسبت به پرتوها
حساسیت بافتهای مختلف بدن در مقابل اشعه متفاوت است. این حساسیت بستگی به حساسیت سلولهای تشکیل دهنده آن بافت دارد. سلولهایی که دارای رشد سریع هستند، مقدار قابل توجهی از دوره سلولی خود را در حالت میتوزی میباشند بنابراین حساسیت این گونه بافتها نسبت به اشعه زیاد میباشد. برعکس سلولهایی که دارای تقسیم سلولی نیستند بایستی در اثر مرگ بین میتوزی در اثر اشعه از بین بروند. لذا اینگونه سلولها دارای مقاومت زیادی در برابر اشعه هستند. ارتباط بین حساسیت بافتها نسبت به پرتو و وضع سلولهای آنها در اوایل قرن 20 توسط دو محقق فرانسوی به نامهای "
برگوینه" و "
تریباندو" به صورت قوانین زیر بیان شده است. هر چه بافتی دارای این سه شرط باشد، نسبت به پرتو حساستر است:
- سلولهایی که هنوز شکل اختصاصی به خود نگرفتهاند و به عبارت دیگر غیر تمایز یافته هستند.
- سلولهایی که فعالیت میتوزی آنها (اندیکس میتوزی) زیادتر است.
- سلولهایی که بیشتر قابلیت تقسیم خود را حفظ کردهاند.
اثر اشعه بر روی سیستم خونساز
سیستم خونساز شامل مغز استخوان ،
سیستم گردش خون و بافتهای لنفاوی مثل
تیموس ،
غدد لنفاوی و طحال میباشد. تاثیر عمده اشعه بر روی این سیستم کاهش مقدار گلبولها در جریان خون میباشد. وابستگی زمانی و دز بر روی سلولهای مختلف خونی توسط محققین بررسی شده است. سلولهای خونی عمدتا در مغز استخوان تولید میشوند و عبارتند از لنفوسیتها ، گرانولوسیتها ، گلبولهای قرمز و
پلاکتها. حساسترین سلولها در مقابل اشعه لنفوسیتها هستند، کاهش تعداد پلاکتها پس از تابش ، به صورت آهسته است. گلبولهای قرمز دارای حساسیت کمتری نسبت به اشعه هستند و احتمالا علت آن مدت عمر زیاد آنها است.
اثر اشعه بر روی پوست
عمده تجربیات تاثیر اشعه بر روی انسان مربوط به اثر آن بر روی
پوست میباشد. پوست طبیعی شامل سه لایه خارجی ، میانی از نوع بافت پیوندی و لایه زیرین از بافت چربی و
بافت پیوندی میباشد. در لایه زیرین اجزای مختلفی از جمله
پیاز مو ، پایانههای عصبی و غدد مترشحه وجود دارند. همه لایهها و اجزای لایهها در حساسیت نسبت به تابش پرتو شرکت دارند. تخریب سلولهای پوست در اثر اشعه موجب "
اریتما" (شبیه آفتاب سوختگی) میشود و پس از این مرحله افزایش دز پرتو موجب زخم میشود. یکی دیگر از حساسیتهای پوست ریزش مو میباشد. تابش اشعه میتواند موجب ریزش مو به صورت دائم یا موقت شود.
اثر بر روی بیضه و تخمدان
دز لازم برای عقیمی دائم اگر به بدن اعمال شود، موجب مرگ میشود. دزهای کمتر میتواند موجب عقیمی موقت شود. بهبود در این حالت در مردها 3 - 2 سال بعد حاصل میشود. در تخمدان زنان اووسیتهای از دست رفته در بدن جایگزین نمیشوند. در اثر تابش 500 - 400 راد اشعه به تخمدانهای زن جواب موجب عقیمی موقت میشود که در مرحله بعدی قاعدگی ، سیکل سلول آن شروع میشود. در دزهای بالاتر ، عقیمی دائم حاصل میشود.
تاثیر اشعه بر روی مغز
تغییرات اشعه روی
مغز ، تورم رگها در ماده خاکستری و سفید و تورم خود مغز میباشد.
تاثیر اشعه بر روی چشم
مهمترین تاثیری که تابش پرتو بر روی چشم میگذارد، ایجاد آب مروارید است. ایجاد
آب مروارید در اثر اشعه وابسته به سن میباشد. با افزایش سن حساسیت عدسی چشم نسبت به اشعه بیشتر میشود و ضمنا دوران کمون آن کمتر است. دوره کمون گزارش شده در مورد انسان بین 30 - 5 سال و بطور متوسط 15 سال میباشد. در مورد بیماران موقعی که چشمها مستقیما مورد تابش ، جهت عکس گرفتن از سر و گردن قرار میگیرند، دز دریافتی عدسی زیاد میباشد و احتمال ایجاد آب مروارید بیشتر خواهد بود.
سرطان
خاصیت سرطانزایی اشعههای یونیزان خیلی زود پس از کشف این پرتوها شناخته شد. بسیاری از فیزیکدانها و پزشکانی که در ابتدا از خاصیت سرطانزایی این نوع اشعه اطلاع نداشتند، به دلیل بکار نبستن نکات ایمنی در اثر سرطان حاصل از اشعه درگذشتند. وقوع انواع مختلف سرطان در افرادی که قبل از تولد مورد تابش قرار گرفتهاند، نسبت به افراد عادی بیشتر ظاهر شده است. این امر بخصوص در مورد سرطان خون صادق است. مادرانی که در دوارن بارداری تحت معاینات
رادیولوژی قرار گرفتهاند، کودکان آنها با احتمال حدود 2 برابر افراد نرمال ، مبتلا به
سرطان خون میشوند. ریسک دیگر سرطانها نیز تا سن 10 سالگی ، 2 برابر میباشد.
لوسمی
وقوع
لوسمی در اثر تابش به شدت وابسته به جنس است. وقوع این بیماری در کودکی در مقایسه با سنین بالاتر خیلی زیادتر است. دلایلی که شاهد بر تاثیر اشعه در ایجاد لوسمی است از منابع زیر بدست آمده است: بازماندگان بمب اتمی در هیروشیما و ناکازاکی ، بعضی بیمارانی که با اشعه درمان شدهاند، تابش گیریهای شغلی ،
رادیوتراپی و تابش اشعه به لگن موجب افزایش وقوع لوسمی میشود. تاثیر اشعه در ایجاد
سرطان خون در مردان 2 برابر زنان است.
سرطان تیروئید
با توجه به آنکه غده تیروئید بسیار کوچک است، احتمال وقوع این نوع سرطان در اثر تابش پرتو زیادتر است. و لذا به نظر میرسد که غده تیروئید نسبت به اشعه حساس است. سرطان تیروئید در زنان 2 برابر مردان اتفاق میافتد. ریسک وقوع در زنان که قبل از سن 20 سالگی مورد تابش واقع شدهاند بیشتر است.
سرطان استخوان
مطالعات انجام شده در تاثیر اشعه بر ایجاد سرطانهای استخوان بسیار محدود است. ولیکن نشان داده شده که اشعههای یونیزان در ایجاد این بیماری موثر است. اشعههای یونیزان سنگین مثل آلفا در ایجاد این بیماری موثرتر هستند. این بیماری در اثر ورود مواد رادیو اکتیو مثل رادیوم به داخل بدن و جذب آنها بوسیله استخوان صورت میگیرد.
چهارشنبه 21/8/1393 - 16:37